factores que afectan al equilibrio químico:
- Principio de Lechatelier
- Efecto de la concentración
- Efecto de la temperatura
El equilibrio puede desplazarse por diversos factores, que podemos clasificar según afecten o no al valor de la constante termodinámica:
Modifican el valor de la constante de equilibrio termodinámica:
· Temperatura
· Presión
· Naturaleza del disolvente
No modifican el valor de la constante de equilibrio termodinámica:
· Actividad del disolvente
· Fuerza iónica
· Reacciones laterales
Cálculos en el equilibrio
El cálculo de las concentraciones en el equilibrio requiere el planteamiento de un sistema de ecuaciones con tantas ecuaciones como especies existan en el equilibrio. Las ecuaciones del sistema proceden de:
· Las constantes de equilibrio.
· Los balances de masas.
· El balance de cargas si es necesario
Principio de Le chatelier
El principio de Le Chatelier, postulado por Henri-Louis Le Chatelier (1850-1936), un químico industrial francés, establece que:
Si un sistema químico en equilibrio experimenta un cambio en la concentración, temperatura, volumen o la presión parcial, entonces el equilibrio se desplaza para contrarrestar el cambio impuesto. Este principio es equivalente al principio de la conservación de la energía.
 Efecto de la concentración
Efecto de la concentración
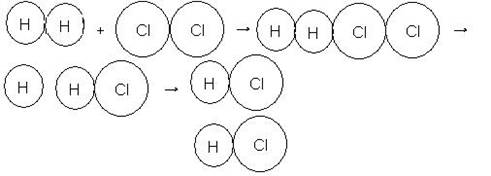
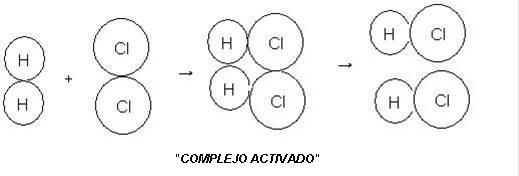
Ley de Guldberg Waage: La velocidad de una reacción es directamente proporcional a la concentración de los reactivos.
El aumento de la concentración de una sustancia presente en el equilibrio hace que el mismo se traslada en el sentido de consumir la sustancia adicionada, esto es, el equilibrio se traslada para el lado contrario al aumento. Ya la disminución de una sustancia retirada, esto es, el equilibrio se traslada para el mismo lado de la disminución.
El efecto de la temperatura sobre el valor característico es la variación de la señal de salida actual a causa de un cambio de temperatura de 10 K determinado con el par de giro nominaly con referencia al valor característico. El valor indicado es el mayor en el rango de temperatura nominal.
El efecto de la temperatura sobre el valor característico (también coeficiente de temperatura del valor característico) es un índice de la influencia de la temperatura a la señal de salida con una carga aplicada al transductor. De la señal de salida se debe restar el valor del par de giro inicial con la misma temperatura. Un estado de la temperatura estacionario deber ser establecido.
Aunque las variaciones en la presión, tampoco afectan la constante de equilibrio, si pueden cambiar la posición del equilibrio, específicamente en los procesos donde cambia el volumen.
Por ejemplo para la reacción de:
Al incrementar la presión el sistema tratará eliminar la tensión ejercida e intentará disminuir la presión. Esto solo se logra alterando el punto de equilibrio en la dirección de la formación de NH3.
Recuérdese ahora además que:
Es posible calcular la extensión del cambio en el punto de equilibrio de una reacción si se altera la presión.
Por ejemplo, en la reacción de disociación:
PCl5(g) = PCl3(g) + Cl2(g)
Al poner 1 mol de vapor de PCl5 en un recipiente de volumen V, se disociara hasta llegar al equilibrio.
Supongamos que la fracción de la sustancia original que se ha disociado es a, y le llamaremos grado de disociación del PCl5. Escribamos ahora las expresiones de las concentraciones presentes para sustituirlas en la de equilibrio.


/termometro2.jpg)





![r = k[A]^{m}[B]^{n} \,\!](http://upload.wikimedia.org/math/d/7/2/d721257f573e003e652dfc0695d96a1f.png) Los términos entre corchetes son las molaridades de los reactivos y los exponentes m y n son coeficientes que, salvo en el caso de una etapa elemental no tienen por que estar relacionados con elcoeficiente estequiométrico de cada uno de los reactivos. Los valores de estos exponentes se conocen como orden de reacción.
Los términos entre corchetes son las molaridades de los reactivos y los exponentes m y n son coeficientes que, salvo en el caso de una etapa elemental no tienen por que estar relacionados con elcoeficiente estequiométrico de cada uno de los reactivos. Los valores de estos exponentes se conocen como orden de reacción.